再生医療とは?最新情報について分かりやすく紹介します。

- 再生医療って何?という人
- 再生医療について学び直したい
- どんな病気が治療できるようになるのか知りたい
ニュースで再生医療という言葉を聞くことが多くなってきたと思います。しかし、あまりピンとこない人が多く、何が変わるのかよく分からない、という人も多いのではないでしょうか?今回は再生医療について分かりやすく解説していきます。
この記事を読むことで再生医療に関する教養を身に付けることが出来ます。
再生医療とは?期待される効果と問題点について分かりやすく解説します。
再生医療とは病気や事故によって失われた体の一部を再生することを目標にした医療のことです。今までは患者自身の持っている治癒力を促進して治療するという方法でした。しかし、それだけだと治らない病気があるね、ということで体外で治療に必要な細胞を増やして投与してやれば、今は治らない病気も治るかもしれないね、という考えで再生医療が発達してきています。
こうした考えの発端はトカゲの尻尾でした。知っての通り切っても切っても生えてきます。これはトカゲの尻尾に再生能力が高い細胞があるからだと考えられます。幸い、人にも小さな怪我をしても自分で治癒する能力があります。これは自分の体の中にトカゲの尻尾のような機能があるからだと考えられます。そのため、治癒の役割を担っている細胞を体外で増やして再び体に戻してやれば、自分では治癒できない怪我や病気も直すことができる、と考えられます。
治療の役割を担う細胞
人間が本来持っている再生機能を突き詰めていくと幹細胞と呼ばれる細胞が治療の役割を担っていることが分かりました。
さらに、幹細胞には種類があり血管、筋肉、神経など何にでもなれる細胞を多能性幹細胞、皮膚に関連する細胞にしかなれないといったある程度分化できる方向が定まったものを体性幹細胞といいます。
- 受精卵は1つの細胞から1人の人間を作り出すから、何にでもなれる多能性幹細胞。
- 生まれた後の体の修復は体性幹細胞が担っている。
多能性幹細胞
再生医療という考え方が生まれた初期に使われていたのはES細胞と呼ばれる細胞です。ES細胞は受精卵から分離してきた細胞なので多能性幹細胞としてよく利用されていました。しかし、倫理面の問題から使用が制限されるという欠点があります。
その欠点を克服したのが有名なiPS細胞です。ES細胞のように体の全ての細胞になる能力を保持した細胞にも関わらず倫理的問題もありません。なぜなら、皮膚や血液の細胞からiPS細胞を作成しているからです。
これにより、今まで治療できなかった疾患を完治させれる可能性がぐっと高まりました。よく知られている臨床研究は加齢性黄斑変性という目の病気の治療ですね。iPS細胞から黄斑と呼ばれる組織を作り出し、病気になった組織と置き換えることを目的としています。今のところ、安全性には問題ないようです。
体性幹細胞(間葉系幹細胞)
一方で、間葉系幹細胞という言葉をニュースで聞いたことのある方もいるかもしれません。この細胞はiPSよりもずっと歴史があり、体の修復を担っている体性幹細胞として研究されていました。未だにどういったメカニズムで修復しているのか分かりませんが、様々な臨床研究が行われています。
- 表面マーカーであるCD73、90、105がポジティブ(細胞集団の95%以上が発現している)であり、CD45、34、14か11b、79aか19、HLA-DRがネガティブ(細胞集団の2%以下が発現している)であること
- プラスチックの容器に接着できる
- 骨、脂肪、軟骨への分化能の保持
重要なのはHLA-DRがネガティブ、ということです。このHLAというのは移植するときに患者の免疫を活性化する機能があります。通常の細胞はHLA-DRも発言しているので移植したときに免疫によって取り除かれるのですが、間葉系幹細胞はHLA-DRがネガティブなので移植したときにも排除されにくいという特徴があります。
また、最近の研究では間葉系幹細胞の放出するサイトカインや成長因子、miRNAと呼ばれるものによって免疫機能が正常に回復したり、疾患によって失われていた細胞が復活するという現象が明らかになりました。
つまり、細胞を移植しなくても細胞から放出される成分を投与することで病気を直すことができるかもしれない、ということです。細胞を投与しなくて済む、というのはリスクが減少するので患者にとって大きなメリットです。
ただ、間葉系幹細胞はは骨髄や脂肪組織、臍帯など様々な場所から採取することができるのですが、採取した場所によって性質が違う可能性も示唆されています。
とはいえ、間葉系幹細胞の研究はES細胞やiPS細胞より進んでおり、いくつかの製品がすでに上市されています。
- テムセルHS注…JCRファーマによって開発された急性移植片対宿主病(急性GVHD)の治療製品です。造血幹細胞移植後に発症する重篤な合併症に対して作られた製品で2016年2月から日本初の他家由来の再生医療等製品として販売を開始しました。
- 自家培養軟骨…J-TECによって開発された再生医療等製品です。整形外科領域では国内初となる膝関節の外傷性軟骨欠損症と離断性骨軟骨炎(変形性膝関節症を除く)を対象にした製品です。2013年4月より保険が適用されています。
- SB623 …サンバイオによって開発された外傷性脳損傷を対象とした製品です。上市には至っていませんが、脳梗塞以外にも脊髄損傷や加齢黄斑変性などにも応用が期待されています(2019年10月時点)。
再生医療により治療できる病気
再生医療の基本的な考え方と、再生医療に使われる細胞の種類について紹介してきました。これらの研究は日々進んでいるのですが、未だ治療方法が確立されていない疾患は333種類報告されています。そして、日本全体で約90万人の患者がいるとされています(平成29年のデータより)。
そこで、どの細胞でその疾患の治療が期待されているのか紹介していきたいと思います。
- パーキンソン病
- 加齢黄斑変性
- 網膜色素変性症
- 筋委縮性硬化症
- 重症心不全
- 脊椎損傷
これらは臨床研究の準備や治験に取り掛かっているものです。iPSはまだまだ研究が進んでいなくて実用化には時間がかかりそうですね。
- アルツハイマー病
- 脳梗塞
- 脊椎損傷
- 変形性膝関節症
- 移植片対宿主病
間葉系幹細胞は世界中で治験が行われていますし、実際に市場に出ている製品もいくつかあります。これからのニュースで間葉系幹細胞という名前を聞く機会は増えてくると思います。
では、いくつかの病気に対してどのような研究が行われているのか紹介していきます。
パーキンソン病
現在、京都大学iPS細胞研究所の高橋淳教授によるパーキンソン病に対する医師主導型の治験が行われています。難病指定されているパーキンソン病をiPS細胞により治療しようという試みです。すでにパーキンソン病モデルのサルを用いた実験により効果の確認ができており、世界的に有名な科学雑誌Natureに報告されています。今回はこの病気について掘り下げていきたいと思います。
パーキンソン病とは
パーキンソン病は中脳の黒質ドパミン細胞が減少することにより引き起こされる病気で、平成29年末時点で約12万人の患者がいることが確認されています。
- 動作が小さい、遅い
- 振戦(手足の震え)
- 姿勢反射障害(バランスが取れない)
- 筋固縮
ドパミンの減少は検出することが難しく、検出できた時にはすでにドパミンの量が全体の半分以下になっていることが知られています。すでにこうした症状を改善する薬としてレボドパと呼ばれるドパミンの前駆物質が開発され、大きな成果を上げています。しかし、効果が長く続かないことや摂取しすぎると体が勝手に動いてしまう不随意運動が起こるという欠点が確認されています 。
細胞治療の利点
細胞治療ではドパミン前駆細胞を外から入れるため、効果が長く続き症状が出ている時間が短くなっていくと予想できます。いくつかの研究では胎児組織から細胞を取ってきて移植することで症状の改善が報告されていましたが、倫理面での問題がありました。そのため、高橋教授らはiPS細胞からドパミン前駆細胞を作成しパーキンソン病の治療に使えないか実験しました。サルを使った実験によりパーキンソン病治療へのiPS細胞の有用性が証明されたため、現在治験を実施している最中です。
- 移植した細胞が線条体に組み込まれ神経のネットワークを構築できるか
- 他家の細胞を使うため併用して使う免疫抑制剤が機能するか
iPS細胞を使う際には常に腫瘍化の危険が付きまといます。そのため、PETと呼ばれる検査により早期に癌を検出し、ガンマナイフと呼ばれる低侵襲の方法で癌の切除を行える体制にしています。また、ドパミンが過剰になることで引き起こされる不随意運動が増加する可能性に対しては特殊な方法で起きないようにできるみたいですが、実際にやってみないと分からない所が大きいみたいです。
現在、パーキンソン病に対しては脳深部刺激療法(DBS)と呼ばれる脳に電極を埋め込む方法やデュオドーパという、胃瘻からパーキンソン薬を直接空腸に持続投与する方法がありますが、金額の面で高額になってしまいます。細胞治療が成功するのであればiPS細胞による治療が一番有用で低コストの方法になるかもしれません。
軟骨治療
iPS細胞研究所の妻木教授らのグループは膝の軟骨損傷に対する臨床研究を行おうとしています。一般的には変形性膝関節症と言われたり、軟骨損傷と言われたりします。ちなみに、軟骨損傷の患者は日本に1000万人近くいるとされています。
軟骨治療の課題
軟骨は血管が通っていないため一度傷ついてしまうとなかなか元に戻らないという特徴があります。そのため、軟骨組織に穴が開いてしまったような状態になり、放っておくとどんどん穴が広がって激しい痛みが出ます。
傷がついてしまう原因としてはスポーツ選手などでよくみられる負荷のかけすぎや年齢、自己免疫による過剰反応など様々なものがあります。完全に治療する方法はなく、現在はマイクロフラクチャーと言って、軟骨と軟骨の下の骨に細かい穴をあけて骨髄液を染み出させる方法が一般的です。これにより、染み出してきた骨髄中の細胞が軟骨を再生してくれます。
しかし、この方法では回復した軟骨の質が悪く、患者の予後が悪くなってしまいます。人工関節に入れ替える方法もありますが、免疫系が人工関節に反応してしまう場合があったり、元の滑らかな動きが再現できないと言う欠点があります。
最近では軟骨組織を取り出して体外で培養して増やした後に軟骨組織の穴の開いた場所に移植する、という方法が開発されてきています。ただ、培養している間に軟骨細胞が劣化してくることが分かっています。そこで、iPS細胞から軟骨細胞を作り出して移植するという方法が検討されてきました。
iPS細胞を用いる利点
妻木教授が行う臨床研究ではiPS細胞から直径数ミリ程度の球状の軟骨組織をいくつか作成し、この球状の組織を数十個程度穴に移植するという方法が用いられるようです。
実際に論文ではマウス、ラット、ミニブタで軟骨の治療ができています。また、この論文の中でiPS細胞から軟骨に分化させる方法も開発されています。ただし、成熟した軟骨細胞ではツルツル滑るためうまく軟骨の穴に収まらないようです。そのため、未成熟な細胞を移植して治療を行っています。
体内で成熟した軟骨細胞になっているかと言われると微妙ですが、周りの軟骨とも一体化しているように見えます。
iPS細胞の安全性
気になるのはiPS細胞の腫瘍化です。iPS細胞は癌細胞と同じように無限に増殖する能力があるため腫瘍化するのではないか?という心配があります。
しかし、何例か動物実験を行っていますが、今のところ確認できていないようです。
他にも軟骨に移植した細胞が他の組織に行ってしまわないか検討しています。これについても細胞中のRNAというものを検出する方法で確認しています。とても微量のRNAも検出できるため信頼性の高いデータが得られます。実際に動物を対象に行なった実験では軟骨以外の組織で人のRNAが含まれていないことを確認しています。
免疫による拒絶反応
iPS細胞を投与するときに一番気をつけなければならないのが、患者の免疫による拒絶反応です。拒絶反応が起こると治療できないだけでなく、病気が悪化する恐れがあります。そのため、妻木教授らのグループはiPS細胞由来軟骨細胞と免疫の関係についても研究を行なっています。
結論から言うと著者たちはiPS細胞から誘導した軟骨にはHLAのABC型しかないため、免疫細胞に反応しにくいということを発見しています。
また、軟骨細胞は免疫細胞と物理的に接しにくいと言う特徴があります。なぜなら、軟骨細胞は細胞外にスポンジのような役割をするコラーゲンⅡを放出することが知られているからです。このコラーゲンⅡにより免疫細胞が軟骨細胞のところまで行く事が出来ません。
この研究を知るための肝となるHLAと呼ばれる分子について解説していきます。
HLAとはヒト白血球型抗原のことで免疫機能が異物を認識する際に使用されます。このHLAが自分とは違うと異物と認識して拒絶反応を引き起こします。
HLAにはABC型とDRDQDP型の2種類があることが知られています。ABC型はA,B,Cの組み合わせを持っており、DRDQDP型はDR,DQ,DPの組み合わせを持っています。さらに、それぞれが何種類ものサブタイプを持っているためHLAには数万種類のタイプが存在します。そのため、自分と同じHLA型の人から細胞を移植してもらう、ということは滅多にできません。
妻木教授らのグループは軟骨損傷を起こしている場所に軟骨を移植することを想定し、軟骨損傷を起こしている部位に多いIFNγにどのように反応するか見ました。IFNγの特徴として炎症を引き起こすことと、HLAの発現を高めるサイトカインであることが知られています。
その結果、iPS細胞由来の軟骨細胞の方が採取してきた軟骨細胞よりもDRDQDP型の発現が弱いことが分かりました。このことからiPS細胞由来の軟骨細胞の方が移植をしたときに免疫拒絶を受けにくいと考えられます。
また、免疫機能を司る免疫細胞と反応させたときにも、NK細胞やT細胞と呼ばれる免疫機能に関わる細胞を活性化せず、安全性が高いことが確認されました。
心不全
心不全とは心臓の機能障害によって呼吸困難や倦怠感、浮腫が出現し運動機能が低下する症状のことを言います。成人では、虚血性心疾患、高血圧、心筋症、不整脈、弁膜症等が心不全の原因となります。日本における心不全の患者数は2015 年で約120 万人と推計されています。今後は、生活習慣の欧米化や高齢化により、心不全の患者数は増加していくと考えられています。
一言で心不全と言っても症状の軽い人もいれば、重い人もいて様々です。まずはそう言った心不全の分類をどのように行なっているか見ていきましょう。
心不全の分類方法
心不全の分類のために左心室の収縮機能を示す左室駆出率(Left Ventricular Ejection Fraction: LVEF)が用いられます。左心室の収縮機能が臨床状態に影響するためです。
分類には次のようなものがあります。
- LVEF40%未満をLVEF の低下した心不全(Hart Failure with reduced Ejection Fraction: HFrEF)。主に薬物療法により治療が行われます。
- LVEF50%以上をLVEF の保たれた心不全(Heart Failure with preserved Ejection Fraction: HFpEF)。治療は高血圧等の原疾患に対して行われることが中心になります。
- LVEF40%以上50%未満をLVEF が軽度低下した心不全(Heart Failure with mid-range Ejection Fraction: HFmrEF)
LVEF50%以上の心不全患者は全体の68.7%を占めており、欧米よりも高い水準にあるようです。
心不全の治療方法
心不全の治療として現在3つの方法があります。
- 薬物療法…アンジオテンシン変換酵素阻害薬(ACE 阻害薬)、アンジオテンシン受容体拮抗薬(ARB)、ミネラルコルチコイド受容体拮抗薬(MRA)、その他(心筋の興奮の抑制を目的としたβ遮断薬、鬱血による労作時呼吸困難や浮腫等の軽減を目的とした利尿薬、不整脈による突然死の予防を目的とした抗不整脈薬、血管拡張薬や強心薬(ジギタリス)等の薬剤)
- 非薬物療法…不整脈による突然死の予防を目的とした植込み型除細動器(Implantable Cardioverter Defibrillator: ICD)、伝導障害による収縮不全の改善を目的とした心臓再同期療法( Cardiac Resynchronization Therapy: CRT)、除細動器機能が追加された心臓再同期療法(Cardiac Resynchronization Therapy-Defibrillator: CRT-D)
- 手術療法…大動脈内バルーンポンプ(Intra Aortic Baloon Pumping: IABP)、経皮的心肺補助装置(Percutaneous Cardio Pulmonary Support: PCPS)、経皮的補助人工心臓(Ventricular Assist Device:経皮的VAD)
ただ、これらを万全にしても現在の医療では下記のような様々な問題があります。
- 高い死亡率…心疾患はガンの次に多い死因となっています。2017 年の調査では、心疾患による死亡は全死亡の約15%を占め、心疾患による死亡のなかでは心不全による死亡が最も多く約40%を占めています。
- 予防・治療の問題…心不全の経過は多くの場合慢性的で長期にわたります。増悪は直線的ではなく徐々に状態が悪化していくため、経過の予測が難しいです。また、心不全の治療目的は、症状緩和、QOL の向上、長期予後の延長をもたらすことですが、臨床経過の特性によりあまり実践できていません。
- 植え込み型VADの問題…心臓移植の待機期間中、殆どの患者は植込み型VAD という装置を装着します。この装置の改良が進められているものの、感染症や血栓症のリスクはゼロではなく医療的ケアが必要です。
再生医療等製品の開発状況
心不全における再生医療等製品の開発状況を表に示します。
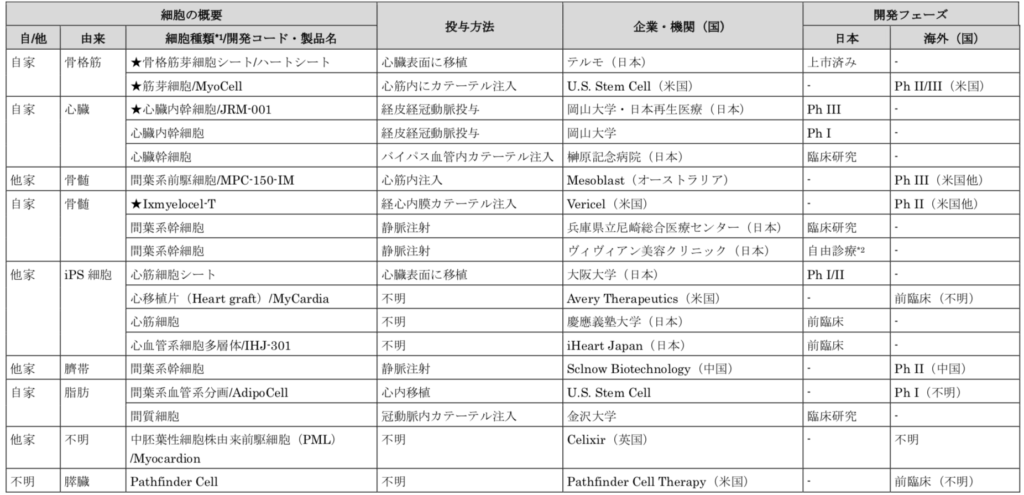
「再生医療等製品とその競合技術の比較調査」報告書 から引用
日本ではテルモ(株)のハートシートが、心不全を対象とする世界初の再生医療等製品として2015 年に承認を受けています。
その他にも、自家心臓組織由来の心臓幹細胞、自家及び他家骨髄由来の間葉系前駆細胞・間葉系幹細胞、他家iPS 細胞由来の心筋細胞等を用いた研究・開発が国内外で進められています。
現在、心不全にて研究・開発が進められている再生医療等製品は、移植された細胞が心筋に分化して問題のある細胞と置き換わるというものではありません。
それよりも、移植・投与される細胞が分泌するHGF、VEGF、SDF-1 等の生理活性物質が血管新生を促進し、線維化を抑制することによって心機能改善効果をもたらすと考えられています。ちなみに、投与方法については、心臓表面への移植やカテーテル注入による局所へのアプローチが中心となっています。
患者の負担について
ここで挙げた再生医療等製品はいずれも自家組織由来であるため組織採取が必要です。採取時や移植時の侵襲性は、麻酔の種類、組織採取量、移植方法によって影響を受けます。開胸手術の場合は侵襲性が高くなりますし、カテーテルを使うのであれば侵襲性は低くなります。
重症下肢虚血
重症下肢虚血とは指先や足先の血液が流れにくくなり、痛みが出たり、壊死してしまう病気です。血管が閉塞する病気の人は全国で40〜50万人いるとされています。
原因として高血圧や糖尿病、喫煙がありますが、中でも糖尿病が大きなリスクファクターとなっており、重症下肢虚血の7割が糖尿病とされています。
初期の段階では痺れや疼痛などが起こり、長い距離が歩けなくなります。この病気が進むと皮膚に潰瘍ができたり、壊疽していき治療できません。最悪の場合には切断することになります。
初期の段階では運動療法や薬物療法が行われ、進行してくると血管内治療や外科的バイパス術が行われています。
重症下肢虚血の治療法
重症下肢虚血の治療法には大きく分けて2つの方法があります。
- 血管内治療
- 外科バイパス手術
血管内治療とは物理的に血管を広げたり、狭くなっている部分を切り取る方法です。血管内治療には主に次の3つがあります。
- 血管形成術…カテーテルにより動脈を広げる方法
- ステント留置…動脈を拡張するためにチューブを挿入する方法
- アテローム切除術…狭くなった動脈を切り取る方法
血管内治療は局所麻酔で低侵襲ですが、病変部位によっては成績が悪いという報告がされています。
外科的バイパス術とは閉塞した血管を迂回する血管を人工的に作成することを言います。適用範囲が大きく効果は大きいのですが、全身麻酔が必要で高い侵襲性のため患者の負担が大きくなります。
また、感染症による高熱や腫れが引き起こされる可能性があります。重症下肢虚血の予後はあまりよくなく発症 1 年後の死亡率は 25%、下肢の切断率は30%とされています。また、全てのケースに適応できるわけではなく、場合によっては重症化しないための保存療法しかない時もあります。
新たな治療方法
現在の治療法では治せない病気でもあるので再生医療で治せないか、という研究が行われています。そこで、有効とされているのが遺伝子治療と細胞治療です。上記では細胞を投与する細胞治療だけ紹介してきましたが、再生医療には遺伝子治療というやり方もあります。
遺伝子治療とは治療に関係する遺伝子を体内に入れ、体内の細胞にその遺伝子を強制的に発現させるという方法です。現在ではHGF、FGF、SDF-1という遺伝子を入れることで治療できないか研究がされているそうです。海外での研究ですが日本のアンジェスやアステラス製薬が関わっているようです。
細胞治療では様々な細胞を使った治療が考えられています。重症下肢虚血の治療に使われる細胞として下記のものがあります。
- 末梢血由来の単核球
- 他家臍帯由来の間葉系幹細胞
- 自家骨髄由来の赤芽球及び間葉系幹細胞
- 自家末梢血由来の単核球
- 自家脂肪組織由来の間葉系前駆細胞
こうした細胞から放出されるHGF、FGF、VEGFなどの液性因子が血管の再構築に関わり症状を軽減するとされています。投与方法としては筋肉注射が多いようです。
しかし、患者によって臨床状態が様々で細胞治療の有効性を示す試験を成立させることが難しいという課題があります。また、液性因子による治療を説明していますが、実際に投与した細胞が患部にとどまっているのかの確認も難しいようです。
再生医療の問題点
再生医療は現在の治療方法で感知できない病気に対して有効だと考えられています。しかし、新しい技術であったり、リスクも大きいことから様々な問題点が指摘されています。
今回は技術的な問題点と制度的な問題点の2つに分けて再生医療の問題点を紹介したいと思います。
技術的な問題点
再生医療を行うにあたり、患者一人ずつ細胞を取り出して増殖させてiPSにして体内に戻すという作業を行うと膨大な時間と費用がかかってしまいます。
そこで、一人の患者から取り出した細胞を増殖させiPSにしていつでも投与できる状態で保存しておくと何人もの患者にすぐに使え、費用も抑えられます。
しかし、ここで培地と移植の問題が生じます。自分の細胞を自分に移植する場合(自家移植)は自分の血清を使って細胞を増殖させればよかったのですが、他人の細胞を自分に移植する場合(他家移植)は血清中のウイルスやファージなどによる感染のリスク、免疫システムによる拒絶反応のリスクができてきます。
これらを解消するために感染の心配のない無血清培地のの開発や免疫システムに反応しにくい特徴を持った人からの細胞の提供が必要になります。
他にもコントロールを置けないという問題もあります。コントロールとは、例えば無処置のグループのことです。再生医療で処置したグループで効果があったといえるのは、無処置の人と比べて統計的にいい結果が出たと言わなければならないからです。
しかし、再生医療が使われる疾患は希少なものが多く統計的にいい結果が出たといえるほどの患者数がいない場合があります。そのうえ、こうした治療は患者や医者のバイアスを排除するためダブルブラインド(患者も医者もコントロール群なのか分からないようにして試験すること)を推奨されていますが、医者が細胞の状態を見て治療するためシステム上難しい場合が多いです。また、疾患には時間とともに変化していくものが多く、患者の症状が改善したとしても自然に回復したのか細胞を入れたことによる改善なのか分からないという問題もあります。
こうしたコントロールが置けない上に治療の条件が複雑になってくると再生医療の有効性を示すためのハードルが高くなってしまします。
制度の問題
2014年のアメリカ移植医学会(ASRM)で病院やクリニックが治療効果のエビデンスなしで細胞治療を行うことができるという決定をしました。(ビジネスを始めるためには厚労省からの細胞加工施設の承認や大臣や委員会からの承認が必要。委員会には生物学や再生医療の専門家は勿論、生物統計学や生物倫理学の専門家が求められているが、そのルールはまだ甘い。)
何も知らない患者はASRMの登録書を見て安心と思うかもしれませんが、科学的根拠のない治療をしてとは限らないということを理解してなければなりません。
また、技術的なコントロールが置けないことやダブルブラインドができないなどルール上の問題がある中でどのような制度にすれば患者にも利益が出て産業としても発展していけるのか考えていかなければなりません。
まとめ
今回は再生医療について一般的な知識と患者に応用するために乗り越えなければならない問題点を紹介しました。
新しい考え方での治療方法なので様々な問題がありますが、そうした問題を乗り越えて多くの人が幸福な人生を暮らせるような社会になればいいと思っています。
もし、再生医療を支援したい、という人はiPS細胞研究所へ寄付しましょう。また、2020年10月からはふるさと納税として支援することもできるようになっています。興味のある人は調べてみてください。
参考記事
・The potent effects of Japan’s stem-cell policies
・Generation of Scaffoldless Hyaline Cartilaginous Tissue from Human iPSCs
・Integration Capacity of Human Induced Pluripotent Stem Cell-Derived Cartilage
・Limited Immunogenicity of Human Induced Pluripotent Stem Cell-Derived Cartilages








